PASOS PARA EL PHOTOSHOP
Aqui teneis los pasos mas sencillos para hacer una foto con el Photoshop:
Paso 1: seleccionar la imagen.
Paso 2: poner la imagen en la pantalla del Photoshop dandole a ''nuevo'' situado en la parte superior izquierda y dentro de nuevo a abrir imagenes y seleccionáis la que habeis guardado anteriormente.
Paso 3: seleccionar otra imagen y cambiar los contenidos o poner la imagen a tu gusto para ello:
a) pones otra imagen repitiendo el paso 2
b) recortas la cara por ejemplo de una persona con el simbolo de un lazo qe aparece arriba a la izquierda y para moverla en la otra imagen le das al simbolo de la flecha que esta encima del del lazo y a la derecha.
c) puedes poner titulos, darle forma a la imagen, oscurecer la imagen, hacer deformaciones de la imagen ; por ejemplo para oscurecer o hacer mas clara la imagen pinchais en el icono de la mano abierta y seleccionais si la quereis oscurecer mas o menos o podeis borrar lo que habeis hecho con el icono del borrador. Hay muchas opciones :)
ME GUSTA LA FISICA
jueves, 13 de enero de 2011
martes, 14 de diciembre de 2010
viernes, 3 de diciembre de 2010
Física - Video 01 - Caída libre en el vacío: demostración
Os dejamos un video sobre cinematica : La caida libre. Esperamos que lo entendais y que os sirva
jueves, 2 de diciembre de 2010
Enlaces atomicos
Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, que se forman para conseguir la estabilidad de sus electrones llegando a la configuracion de gas noble:
(ns2 np6)
Enlace iónico
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.5 suele ser covalente. En palabras más sencillas, un enlace iónico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catión y un anión) o dicho de otra forma, es aquel en el que un elemento más electronegativo atrae a los electrones de otro menos electronegativo El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.
Sus características son:- Son sólidos cristalinos
- poseen fuertes puntos de fusión y ebullicion debido a la fortaleza de sus enlaces
- sulen ser solubles en agua
- en disolución acuosa, son buenos conductores de la electricidad debido a la existencia de inoes libres
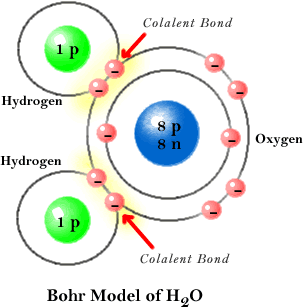
Enlace covalente
El enlace covalente polar es intermediado en su carácter entre un enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra.
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
En otras palabras, el enlace covalente es la unión entre átomos en donde se da un compartimiento de electrones, los átomos que forman este tipo de enlace son de carácter no metálico. Las moléculas que se forman con átomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula. Se expresan mediante la estructura de Lewis
Sus caracteristicas son:
- son gases o líquidos
- Puntos de fusión y ebullicion bajos
- poco solubles en agua
- Disueltos en agua, conducen mal la corriente electricidad
Enlace metálico
En un enlace metálico, los electrones de enlace están deslocalizados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas es estática. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza.
Sus caracteristicas son:
- Solidos a temperatura ambiente(menos el Hg)
- Alta densidad
- Temperaturas de fusion y ebullicion altas
- Buenos conductores de la electricidad y el calor gracias a la existencia de electrones sueltos
- Son dútiles y maneables
Tabla Periódica
aqui teneis una tabla periodica, para que la estudieis
Por favor, visitad esta pagina:
http://tablaperiodica.educaplus.org/
que tiene juegos, ejercicios, fotos, teoria........
Por favor, visitad esta pagina:
http://tablaperiodica.educaplus.org/
que tiene juegos, ejercicios, fotos, teoria........
Suscribirse a:
Entradas (Atom)